
近日,南京邮电大学材料科学与工程学院、有机电子与信息显示国家重点实验室汪联辉教授团队晁洁教授在蛋白质降解与肿瘤治疗领域取得新进展。相关成果以“Intelligent Modular DNA Lysosome-Targeting Chimera Nanodevice for Precision Tumor Therapy”为题发表在Journal of the American Society(《美国化学学会杂志》)上。晁洁教授为论文的通讯作者,青年教师崔美荣为论文的第一作者。
蛋白质降解是一种利用被称为蛋白质降解剂的肿瘤治疗策略。目前通过蛋白酶体或溶酶体系统选择性地靶向降解特定蛋白,在肿瘤治疗中具有明显的优势。溶酶体靶向嵌合体(LYTACs)作为一种通过劫持溶酶体转运受体(LTRs)来降解细胞外靶蛋白的策略,已成为消除传统上不可药的肿瘤相关致病蛋白的一种强有力的方式。然而,其低生物利用度和非特异性分布严重限制了肿瘤治疗的效果。随着“事件驱动”药物模型的推进,优化降解模式,开发一种能够选择性靶向肿瘤组织并实现模块化设计的LYTACs系统势在必行,这将有利于扩宽治疗窗口,促进肿瘤精准治疗的发展。
为了实现这一目标,汪联辉教授、晁洁教授带领的团队设计了一种可编码DNA纳米平台,利用智能模块化DNA LYTACs(IMTACs)纳米器件,在肿瘤微酸环境中特异性降解多种致病蛋白。DNA环状折纸具有高稳定性、低免疫原性和可编程性,及近端排布等优点,满足了对不同配体的精准排布的需求,是IMTACs的理想纳米载体。通过精确控制LTRs和蛋白配体的化学计量学和模块化分布,IMTACs纳米器件能够精确定位和递送到肿瘤组织中。在肿瘤组织中,酸性肿瘤微环境触发激活降解开关,IMTACs多价结合,并有效降解各种预先指定的蛋白质。IMTACs的组织特异性和多价配体显著提高了药物利用率,同时减少了脱靶效应。重要的是,该系统显示了肿瘤组织中EGFR和PDL1协同降解的能力,可用于肝细胞癌(HCC)的联合靶向和免疫治疗。此外,DNA折纸纳米结构可以结合不同类型的靶配体(适体、RNA、肽、抗体等),从而促进了新的靶蛋白降解剂的灵活设计。该研究扩大了靶向蛋白降解的范围,并为发现各种疾病的创新疗法提供了新的思路。
该研究得到了国家基础科学中心、国家自然科学基金、江苏省前沿引领技术基础研究专项和江苏省自然科学基金等项目支持。
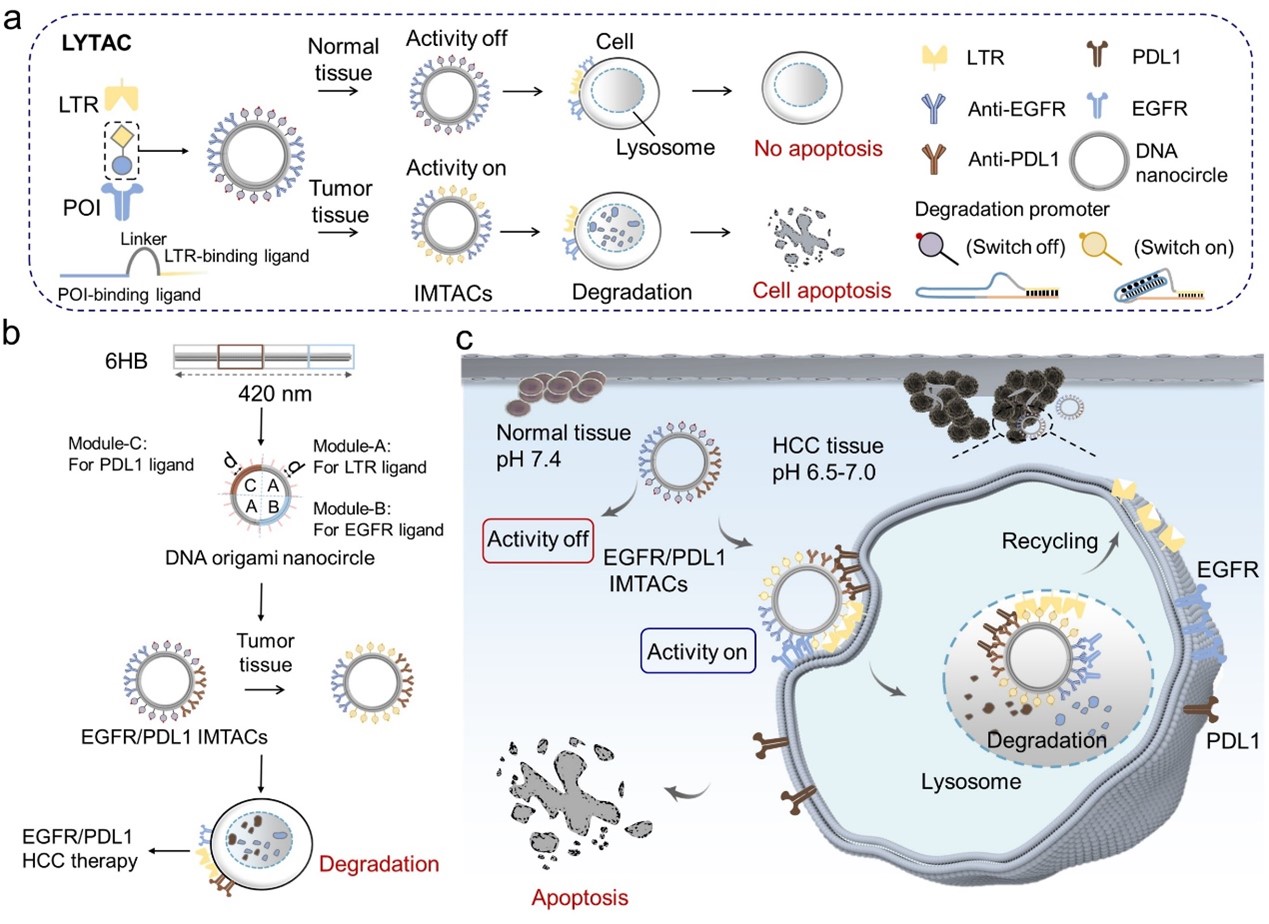
图1:IMTACs设计原理以及蛋白协同降解和靶向免疫联合治疗机制
原文链接:https://pubs.acs.org/doi/10.1021/jacs.4c10010
撰稿:崔美荣 编辑:陈宁娜 审核:凌海峰

